Tau蛋白缠结是如何在大脑中形成的
Tau蛋白缠结是如何在大脑中形成的
标题:在阿尔茨海默病患者的大脑中,tau 蛋白的异常聚集在神经元内积累并形成缠结(以蓝色显示),损害神经细胞之间的突触通讯。
制作人员:图片:美国国立卫生研究院国家老龄化研究所
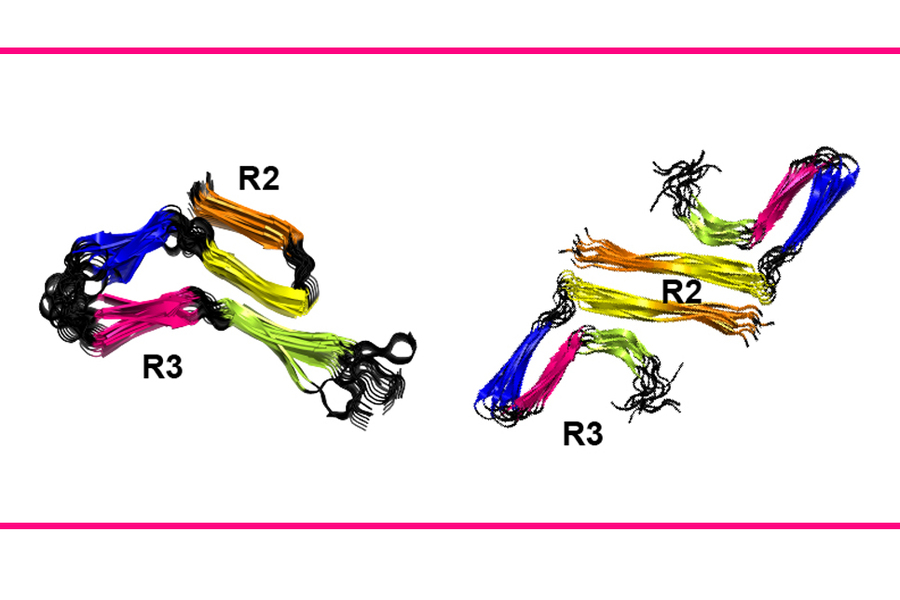
标题:麻省理工学院的化学家已经确定,Tau 蛋白的一个片段 R2 比其他片段更加灵活,这使得 Tau 蛋白在不同条件下呈现不同的构象。
制作人员:图片:由研究人员提供
许多神经退行性疾病,包括阿尔茨海默氏症,其特征是称为 Tau 原纤维的缠结蛋白。在一项新的研究中,麻省理工学院的化学家深入了解了这些原纤维的形成方式,并确定了可能干扰这种形成的药物的潜在靶点。
在这项新研究中,研究人员发现 Tau 蛋白的一个片段比预期更灵活,这种灵活性有助于原纤维呈现出各种不同的形状。他们还表明,当 Tau 蛋白的末端被切断时,这些原纤维更有可能形成。
“这种蛋白质裂解在阿尔茨海默病中相对较早发生,这有助于加速聚集,这是不受欢迎的,”麻省理工学院化学教授、这项新研究的资深作者梅红说。
研究人员还确定了一系列氨基酸序列,这些氨基酸序列似乎有助于 Tau 蛋白向不同方向弯曲,他们认为这可以成为干扰 Tau 缠结形成的药物的良好靶标。
麻省理工学院博士后 Nadia El Mammeri 是这项研究的主要作者,该研究发表在今天的《科学进展》杂志上。麻省理工学院博士后 Pu Duan 和 Aurelio Dregni 也是该论文的作者。
原纤维形成
在健康的大脑中,Tau 蛋白与微管结合并有助于稳定它们。该蛋白质包含四个重复亚基,每个亚基略有不同,称为 R1、R2、R3 和 R4。在患有阿尔茨海默氏症和其他神经退行性疾病的人的大脑中,异常的 Tau 蛋白会形成聚集在一起的细丝,从而导致大脑中的缠结。
更多地了解这些细丝的结构可以帮助研究人员弄清楚异常的 Tau 蛋白是如何错误折叠的,但由于其固有的无序结构,研究这些细丝一直很困难。在这项研究中,研究人员利用实验室重组 DNA 生成的 Tau 蛋白版本,利用核磁共振 (NMR) 来确定其中一些结构。
研究人员重点关注 Tau 蛋白的核心,其中被称为 β 片层的折叠蛋白链形成了非常刚性的结构。该内核由软盘段组成。虽然这些软盘部分的确切结构尚不清楚,但研究人员使用电子显微镜表明它们形成了围绕中央核心的“毛茸茸的外套”。
为了探索当这些末端片段丢失时会发生什么(就像阿尔茨海默病中经常发生的那样),研究人员将它们切掉,然后使用核磁共振分析所得的蛋白质结构。研究人员发现,如果没有这些松软的部分,刚性核心更容易形成细丝。这表明毛茸茸的外壳有助于防止蛋白质形成细丝,这可能对神经退行性疾病具有保护作用。
“这告诉你,天然蛋白质中的绒毛外壳实际上具有保护作用。它减缓原纤维的形成。一旦你去掉这些部分,聚合过程就会变得更快,”洪说。
蛋白质的灵活性
研究人员还发现,构成刚性核心大部分的 R3 重复序列本身非常刚性。然而,构成核心其余部分的 R2 重复序列更加灵活,可以根据温度等环境条件产生不同的构象。
“这一发现强调了环境如何在原子水平上影响聚集体的形式和形状,类似于变色龙如何适应环境的颜色。温度的微小变化就足以改变聚集体的整体形状,这必须被认为是令人惊奇的,并且通常在功能系统中观察不到。”苏黎世联邦理工学院化学和应用生物科学教授罗兰·里克(Roland Riek)说,他没有参与这项研究。研究。
研究人员表示,在不同的条件下,R2 可以作为直段或铰链段存在。他们认为,这种构象灵活性可能解释了在不同疾病中发现的 Tau 蛋白结构的细微差异,包括阿尔茨海默病、皮质基底节变性和嗜银颗粒病。
在 R2 重复序列中,研究人员还确定了一个由 6 个氨基酸组成的序列,这些氨基酸似乎使该结构比其他 R 片段更加灵活。Hong 说,这个区域可以为抑制 Tau 原纤维形成的药物提供一个可及的靶点。
“R2 的这个区域在构象上是可塑的,因此也许这是一个可以被小分子药物靶向的脆弱点,”她说。“R3 区域非常稳定和刚性,因此可能很难通过关注该部分来分解 Tau 原纤维。”
研究人员现在计划探索是否可以通过在特定位置截断蛋白质或添加与阿尔茨海默病和其他神经退行性疾病患者大脑中提取的 Tau 蛋白结构更接近的 Tau 结构。那些疾病。
该研究由美国国立卫生研究院和 NIH Ruth L. Kirschstein 个人国家研究服务奖资助。
 麻省理工学院
麻省理工学院


留学方案申请